国考一号1语文答案
国考一号1语文答案 ,目前我们已经整理了国考一号1语文答案 的各科答案和试卷,更多国考1号答案请关注本网站。

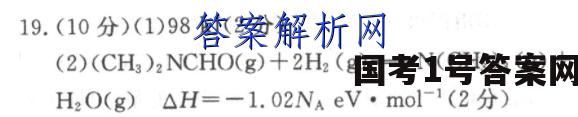


19.(10分)(1)98kJ(2分)(2)(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g)△H=-1.02NaeV·mol-1(2分)(3)NH(ag)+2O2(g)-NO3(aq)+H2O(1)+2H+(aq)△H=-346kJ·mol-1(2分)(4)CH,OH+0,(g)—C0.(g)+2H,0D△H=-a+b+4ck·mol1(2分)2(5)4FeC03(s)+O2(g)-2Fe2O3(s)+4C02(g)△H=-260kJ·mol厂1(2分)【解析】(1)由题干提供的热化学反应方程式可知,每转移12mol电子,反应放出1176kJ的热量,故该反应过程中,每转移1mol电子放出的热量为1176k=98kJ。12(2)由反应历程图可知,反应物的总能量比生成物的总能量高出1.02NAeV,故该热化学方程式为(CH3)2NCHO(g)+2H2(g)-N(CH3)3(g)+H2O(g)△H=-1.02NaeV·mol-1。(3)根据盖斯定律可知,目标反应:NHt(aq)十2O2(g)-2H+(aq)+NOs(aq)+H20(1)△H=△H1+△H2=(-273kJ·mol-1)+(-73kJ·mol-1)=-346kJ·mol-1。(4)根据盖斯定律可知,△H=-a十b十4ckJ·mol1,2故表示CH3OH(1)燃烧热的热化学方程式为CH,OH)+号0:(g)一C0,(g)+2H,0()△H=-a+b+4k灯·mol1。2(5)根据盖斯定律,①十②×4一③×2可得4FeC03(s)+O2(g)-2Fe2O3(s)+4C02(g)△H=(-1648kJ·mol-1)+(-393kJ·mo-1)×4-2×(-1480kJ·mol1)=-260kJ·mol-1。

12.A【解析】由三步基元反应可知,反应的中间体只有NO2和O两种,A项错误;由图可知,第二步、第三步反应中反应物的总能量都大于生成物的总能量,均为放热反应,B项正确;由三步基元反应可知,第一步反应的活化能最大,反应速率最慢,而慢反应决定总反应速率的快慢,C项正确;由反应可知,氮氧化物能使臭氧不断的转化为氧气,严重破坏臭氧层,D项正确。

